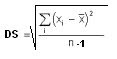Universidad de Oriente.
Núcleo Bolívar.
Escuela de ciencias de la salud, “Francisco Battistini Casalta”
Laboratorio de Bioquímica Clínica.
Control de Calidad en el Laboratorio de Bioquímica Clínica.
Bachiller: González, Angelica.
Profesor: Lic. Germán Guzmán.
Ciudad Bolívar, Abril de 2008.
Índice.
Introducción ...02
Fundamentos del Método
Reactivos usados
Muestra
Preparación de una mezcla de suero de valores normales
Procedimiento del método
Limitaciones del Método
Resultados
Cálculos Estadísticos
Gráfica de control de Calidad
Análisis
Bibliografía ... 08
Introducción
El control de calidad en el laboratorio de bioquímica clínica, permite cubrir un nivel elevado de calidad en cuanto al producto usado, al servicio prestado, a la gestión social y a la salud del paciente.
El conjunto de métodos de control, aplicados en dirección de las actividades como un primer lugar, para la toma de decisiones dentro del proceso analítico. Un control de calidad interno (intralaboratorio), permite la valoración analítica del trabajo realizado en el laboratorio, a pesar de la utilización de buenas técnicas, instrumentos (semi o automatizados), reactivos y estándar de referencia, no pueden garantizar siempre una buena exactitud y precisión de los resultados analíticos; que permitirá decidir la elaboración del informe con los resultados del paciente al Médico.
Mediante cálculos estadísticos y gráficas de control, se analizan si los resultados de los controles están dentro de los límites de referencia, en casos contrarios, reconstituir nuevos controles o repasar el procedimiento y el sistema analítico.
Las mezclas usadas para programas de control, son los sueros congelados (preparados en el laboratorio), o liofilizados (obtenidos comercialmente); los sistemas de calidad empleados en todos los laboratorios, ya sean para control de la calidad intralaboratorio o interlaboratorio, deben evaluar la confiabilidad de los procedimientos analíticos para obtener resultados cuantitativamente con una buena precisión y exactitud.
Los sueros congelados preparados en el laboratorio donde se realizará el Programa de Control son de excelente calidad y reproducibilidad para los fines que se persiguen. Otra ventaja importante de los sueros congelados es que se dispone de gran cantidad en laboratorios normales y es de bajo costo su preparación y almacenamiento. Los sueros liofilizados deben manejarse con más cuidado porque existe error al reconstituirlos y son de costo más elevado que el anterior.
Es importante señalar que no existe un Programa de Control que sea el mejor ya que cada laboratorio debe determinar y adaptar uno con las particularidades de éste.
Control de Calidad.
Determinación de Colesterol total (mg/dl), por
Inserto de
Colesterol Total.
Fundamentos del Método.
La determinación del colesterol total esta basado en el procedimiento enzimático (descrito por Allan):
Esteres de colesterol Colesterol Estearasa Colesterol Libre + Ácidos Grasos
Fenol + 4-aminoantipirina + 2 H2O2 Peroxidasa Cromoforo de quinoneimina + 4H2O
Reactivos usados.
-Reactivo enzimático. Contiene: 4- aminoantipirina, Fenol, Colesterol Estearasa, Colesterol Oxidasa, Peroxidasa, activadores, estabilizadores y Buffer. Condiciones: refrigerado entre 4-
-Estándar de Colesterol (200 mg %): es una solución de colesterol monometil etilenglicol, y activadores. Condiciones: refrigerado entre 4-
Precaución: las soluciones de estándar son venenosas si son absorbidas a través de la piel y muy peligrosa si se inhalan sus vapores. Lave las manos vigorosamente después de su uso.
Muestra.
Suero recién extraído y no hemolizado. También se pueden usar plasma obtenido con EDTA.
El colesterol en suero o plasma es estable:
-Por 5 día a temperatura ambiente.
-2 semanas refrigerado
-6 meses si se congela.
Recomendaciones: Un ayuno de 12-14horas antes de la extracción de la muestra, sobre todo si también se le va hacer la determinación de triglicéridos a la misma muestra. Sin no cumplen este requisito no deben usarse para determinar colesterol y HDL-Colesterol.
Preparación de una mezcla de suero de valores normales.
1-Calcular el volumen diario de control a utilizar sumando todas las fracciones de ensayo que usamos para cada analito. Supongamos que los analitos implicados en el Programa de Control son: glucosa, colesterol, triglicéridos, ácido úrico, urea, y creatinina, y se realiza una sola corrida analítica por día para cada uno de éstos: glucosa (10 l) + colesterol (10 l) + triglicéridos (10 l) + ácido úrico (20 l) + urea (20 l) + creatinina (100 l) = 170 l (0,17ml). Una vez que sabemos que volumen diario de pool control necesitamos, debemos calcular el volumen total a recolectar y por ende la cantidad de tubos de ensayo que necesitaremos. Esto depende del tipo de programa que se escoja (para un periodo de control de
2-Se recolecta el excedente de los sueros que se usan diariamente en envases oscuros de plástico hasta completar el volumen deseado y se conservan en el freezer entre
3-Para preservar la conservación y por lo tanto la pureza de lo controles, lo que se debe realizar es dispensar 1 ml de pool de control por un tubo, y así de esa manera cada día se sacará del freezer un solo tubo para su uso con las corridas analíticas sin afectar ni contaminar el resto de los tubos de control. Se recomiendo usar tubos tipo de 2 ml de capacidad por comodidad y seguridad en el manejo de éstos.
4-Una vez que se ha recolectado la totalidad del volumen del pool de sueros, se saca los distintos frascos con pool del freezer y se dejan fundir en un baño de agua a
5-Dispensar en tubos de centrífuga cónicos de plástico 10 ml. Centrifugar a 3.200 RPM aproximadamente por
6- Extraer el suero de los tubos con una pipeta Pasteur o similar sin llegar al fondo del tubo para evitar remover y aspirar el sedimento. Se Recomienda que se llegue hasta donde comienza el cono inferior del tubo de centrífuga. El sobrenadante se vierte en un vaso de precipitados o Erlenmeyer para su agitación.
8-Dispensar el suero (por ejemplo: 1 ml) del pool en los tubos.
9-El lote de controles se coloca en el freezer y se deja 10 días antes de comenzar a usarlo.
Procedimiento del método.
1-Marcar 3 tubos: Tubo 1 para la muestra (M), Tubo 2 para el estándar de referencia (ER) y Tubo 3 para blanco reactivo (BR).
2-A cada tubo (1, 2 y 3) agregar 1 ml de reactivo de colesterol.
3-Pipetear 10 l (0,010 ml) de la muestra y agregar al tubo 1. Tape y mezcle por inversión.
4-Pipetear 10 l (0,010 ml) de estándar de colesterol total y agregar al tubo 2. Tape y mezcle por inversión.
5-Pipetear 10 l (0,010 ml) de agua destilada y agregar al tubo 3. Tape y mezcle por inversión.
6-Incubar todos los tubos a
7-Después de incubar, mezclar por inversión cada tubo y lea en el espectrofotómetro dentro de los 30 minutos siguientes.
8-Leer a 500 nm, llevar a 0% abs., con el blanco reactivo. Leer el tubo 1 y 2 y anotar las Absorbancias. (esto dependerá del equipo utilizado, algunos dan las concentraciones del analito en estudio).
Nota: se recomienda el uso de sueros controles normales y anormales, comerciales de calidad reconocida.
Limitaciones del Método.
-Niveles de ácido ascórbico tan altos como 10 mg %, No Interfieren en la prueba
-El presente método de Colesterol, á demostrado ser lineal hasta 500 mg/dl. Mas allá de este límite, las muestras deberán diluirse con solución salina (0,85%) y ensayadas nuevamente. El nuevo resultado deberá multiplicarse por el factor de dilución
Resultados.
Tubo Muestra | Concentraciones (mg/dl) |
1 | 37 |
2 | 41 |
3 | 40 |
4 | 47 |
5 | 41 |
6 | 57 |
7 | 53 |
8 | 51 |
9 | 60 |
10 | 57 |
Estándar de Referencia | 200 mg/dl |
Factor de Calibración | 723 |
¡Cálculos Estadísticos.
X =(37 + 41 + 40 + 47 + 41 + 57 + 53 + 51 + 60 + 57) mg/dl / 10
S2 = 624 (mg/dl) / 10-1 = 69 mg/dl
= 8 mg/dl
+/- 1DS = 1 (8) +/- 48 = 40; 56
IE = Intervalo Esperado

Análisis.
La gráfica de Levey- Jennings, para el control de calidad interno (Procedimiento que utiliza los resultados de un solo Laboratorio con el propósito de controlar la calidad), en la determinación de colesterol total, por la casa comercial Laboratorios Biogamma C.A. donde los resultados de los controles obtenidos son aceptables, tienen buena precisión, que se encuentran dentro del intervalo esperado (+/-2DS), y según las reglas múltiples de Westgard se evaluó la calidad del proceso analítico realizado.
Con el control estadístico de calidad se monitorea, mediante técnicas estadísticas, la estabilidad del proceso, y con los gráficos de control representar la variabilidad de las mediciones, para detectar alguna causa de error que se podrá corregir. Estos Programas de calidad tienen como propósito asegurar la confiabilidad de las Pruebas analíticas llevadas a cabo en la muestra de un paciente.
Bibliografía.
Inserto de Laboratorios Biogamma C.A. Química Sanguínea. Caracas- Venezuela: Edif. Frangiu,
<http://calidadbioquimica.com.ar/control.htm. 26/04/2008